16 Abr | 2025
La Comisión Europea aprueba lecanemab para el tratamiento del Alzheimer en fases iniciales
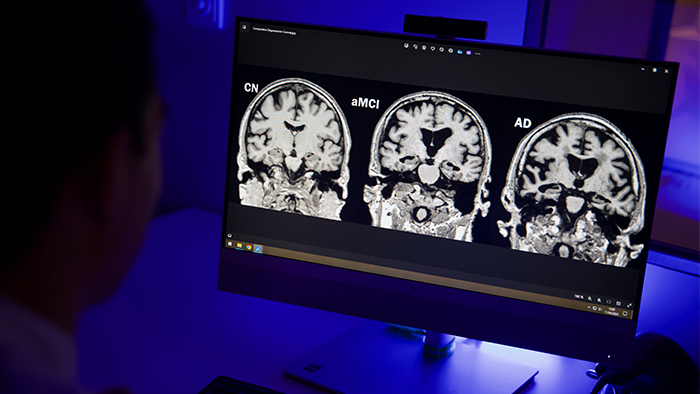
Imagen de resonancia magnética de un participante
La Comisión Europea ha autorizado la comercialización de lecanemab (Leqembi) para el tratamiento de personas con enfermedad de Alzheimer en fases iniciales o con deterioro cognitivo leve debido a esta patología. Con esta aprobación, que llega tras la recomendación positiva emitida por la Agencia Europea del Medicamento (EMA) en noviembre de 2024, se permite la comercialización del medicamento en todos los Estados miembro y se inicia el proceso de evaluación para integrarlo en los diferentes sistemas de salud pública.
En España, la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) será la encargada de establecer las condiciones de financiación y uso del fármaco dentro del Sistema Nacional de Salud. Este proceso implica valorar su coste-efectividad, establecer criterios de acceso y definir los procedimientos para el diagnóstico y seguimiento de los pacientes candidatos al tratamiento.
En este sentido, Arcadi Navarro, Director de la Fundación Pasqual Maragall y el Barcelonaβeta Brain Research Centre, centro de investigación de la Fundación, recalca que “Hemos pasado una prueba, sin embargo, el verdadero desafío comienza ahora: la inclusión del fármaco en los sistemas nacionales de salud. Este proceso administrativo es crucial, pero puede y debe acelerarse. España debe asumir como prioridad la negociación y comercialización del tratamiento. No podemos fallar: reducir el tiempo entre la aprobación y la disponibilidad efectiva no es solo un objetivo estratégico, sino una cuestión de responsabilidad social y sanitaria.”
Lecanemab, el primer tratamiento modificador de la enfermedad de Alzheimer
Lecanemab es el primer fármaco aprobado en Europa que modifica el curso del Alzheimer al actuar directamente sobre su fisiopatología, concretamente reduciendo los depósitos de beta-amiloide en el cerebro. Su uso está indicado exclusivamente en pacientes con una confirmación de la presencia de esta proteína y en estadios muy tempranos de la enfermedad. Además, estará indicado en pacientes con una o ninguna copia del gen ApoE4, quienes presentan menor riesgo de anormalidades relacionadas con el amiloide (ARIA), un efecto secundario que implica hinchazón o pequeñas hemorragias cerebrales.
Esta decisión marca un avance significativo, ya que hasta ahora los tratamientos disponibles se centraban principalmente en aliviar los síntomas, sin incidir en los mecanismos subyacentes del deterioro cognitivo. Los ensayos clínicos han demostrado que lecanemab puede ralentizar la progresión del deterioro cognitivo en fases iniciales en un 27%, lo que podría traducirse en una mejora en la calidad de vida de los pacientes y sus familias.
Esta aprobación es un paso clave en el avance hacia tratamientos que actúan sobre los mecanismos biológicos de la enfermedad de Alzheimer. Es crucial una correcta implementación en el Sistema Nacional de Salud, que requerirá una inversión sostenida en diagnóstico precoz y el acceso a biomarcadores.









